Sino all’inizio del xx secolo la struttura della materia non fu compresa in modo completo. O meglio, senza sapere che cosa fosse realmente un elemento dal punto di vista fisico, Dmitri Mendeleev tracciò correttamente la dipendenza periodica delle proprietà degli elementi dal loro peso atomico sin dalla fine degli anni ’60 del xix secolo.
Nei periodi precedenti, non era agevole né concettualmente semplice dividere i composti dagli elementi puri. Ciò valeva anche per l’alluminio, del quale già nel 1782 il chimico francese Antoine Lavoisier ne postulò l’esistenza a partire dall’analisi di un suo ossido come l’allume. Un quarto di secolo dopo, nel 1808, Sir Humprey Davy, celebre chimico inglese, gli diede pure il nome che arriva sino a oggi: aluminum, erroneamente interpretato da alcuni come derivante da a-lumen,“senza luce”, e in realtà originato da alum, ossia “sale amaro”.
Sempre Davy, a un solo anno di distanza dal “battesimo” dell’alluminio, lo ricavò in forma pura, agendo con un arco elettrico su di un bagno di ferro fuso e allumina: pur con un’energia elettrica ancora tutta da scoprire (la pila di Volta non aveva ancora compiuto 10 anni), si inizia a tracciare la strada che porterà allo sfruttamento diffuso di questo metallo.
Un altro nume tutelare della scienza elettromagnetica, il danese Hans Christian Oersted, ottenne quantità più rilevanti di questo metallo nel 1825. E si deve a Frederick Wöhler, che passerà alla storia per le sue trattazioni degli sforzi a fatica dei metalli, la produzione di piccole sfere di alluminio, pur non più grandi della capocchia di uno spillo. Il contributo di Wöhler arrivò al determinare il peso specifico dell’alluminio.
Che il fattore dimensionale fosse critico non solo per l’effettiva possibilità di usare il “nuovo” metallo, ma pure per suscitare interesse nei suoi confronti, è dimostrato dai risultati ottenuti dal francese Henry-Etienne Sainte-Claire Deville. Costui, un anno solo dopo Oersted, riuscì a ottenere quantità isolate di alluminio puro della grandezza di palle da biliardo, attirando l’attenzione addirittura di Napoleone III, che lo supportò nelle sue ricerche. Tale era il fascino eserciatato dall’alluminio che dopo l’Exposition universelle di Parigi del 1855, occasione nella quale Sainte-Claire Devill potè mostrare le prime barre di alluminio prodotte sino a quel momento, proprio queste barre furono esposte accanto ai gioielli della Corona.
La scala di attività era ancora troppo modesta, e aumentò in modo notevolissimo quando l’americano Charles Martin Hall, dall’alto dei suoi 23 anni, ideò un metodo elettrolitico per la produzion di alluminio puro. Correva l’anno 1886, e il panorama dello sfruttamento dell’energia elettrica era cambiato: il trasformatore, ad esempio, consentiva il trasporto a distanza dell’energia elettrica, mentre le potenze installate aumentavano in modo sensibile.
Hall fu in grado di scindere gli ossidi dell’alluminio facendo passare una intensa corrente elettrica in una soluzione di criolite e allumina. In Francia, dal canto suo, Paul L. T. Herault ideò un metodo pressoché identico, pur non avvertendo la portata commerciale dell’invenzione. Alla prova dei fatti, il sistema Hall-Herault, che prende il nome da entrambi i suoi ideatori, si mostrò produttivo, economico e di facile gestione ed applicazione industriale.
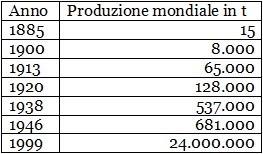
Nel 1888 il celebre chimico tedesco Karl Joseph Bayer brevettò un nuovo sistema per ottenere l’allumina; il metodo Bayer è punto di partenza del ciclo industriale del prodotto. Che i metodi Hall-Herault e Bayer fossero un’ottima soluzione lo si evince dalla tabella qui vicino, che riporta le quantità di alluminio prodotte dalla fine del xix secolo sino alla fine del xx.
Nel momento in cui si rese facilmente disponibile, la leggerezza unita alla resistenza dell’alluminio lo eressero al metallo non ferroso più largamente impiegato.
A titolo di paragone, il dato del 1999 permette di compiere un paragone tra i 24 milioni di tonnellate di alluminio prodotte e i 14 di rame, i 6 di piombo e le “sole” 200 mila di stagno.
I settori di applicazione dell’alluminio sono moltissimi ed estesissimi: basti dire che l’aeronautica dopo la Seconda guerra mondiale deve buona parte del suo repentino sviluppo all’uso dell’alluminio per la costruzione di ali e fusioliere; anche molti altri mezzi di trasporto utilizzano massiciamente questo metallo. Altro ambito è quello degli imballaggi: le lattine delle bibite (e non solo) sono costituite di alluminio; così lo sono molti serramenti e così parti importanti dei nostri elettrodomestici e di altri utensili presenti nelle cucine; negli ultimi tempi l’alluminio ha addirittura sostituito il rame nella realizzazione di linee elettriche, per via del buon rapporto conduttività/peso+costo.